이번에는 Cyclic voltammetry (CV, 순환 전압 전류법)이라고 불리는 전기화학 분석법에 관해 알아보겠습니다.
1. CV의 측정 메커니즘
2. Non-Faradaic system 에서의 CV 결과 그래프
3. Faradaic system 에서의 CV 결과 그래프
1. CV 측정 메커니즘
CV의 input stimulus는 linear sweep voltammetry (LSV)와 매우 유사합니다.
지난 번에 알아본 거 처럼, LSV는 일정한 scan rate로 sweep하여 전위를 가해주고, 전위에 따른 전류의 변화를 i-E curve로 확인하는 것입니다.
Linear Sweep Voltametry (LSV) for faradaic system
이번에는 산화 환원 반응이 존재하는 시스템에서의 LSV에 대해 알아보겠습니다. 1. 산화 환원 반응이 i-E curve에서 어떻게 표현되는지 알아보기 + 전류 약간2. 두 활성종의 존재하는 시스템에서의
graduate10.tistory.com
아래 그림 1은 LSV의 input stimulus 입니다.

일정한 scan rate를 가지고 시스템에 더 negative한 potential을 가한다고 해석할 수 있을 거 같습니다.
아래 그림 2와 같이 CV에서는 forward scan후에 다시 initial potential로 sweep하기 위해 backward scan을 가해줍니다.

Forward scan에서, 더 negative한 potential을 가하기 때문에 산화종이 존재한다면 환원될 것이고 따라서 cathodic scan이라고 부를 수 있습니다.
Backward scan에서는 앞선 설명대로 potential이 다시 initial potential로 돌아 옵니다. 이런 주기가 반복 되면서 시스템의 활성종이 산화 환원 되는데요.
이런 반복을 수행함으로서, 활성종의 산화환원 반응이 안정적인지, 가역적인지 확인할 수 있습니다.
Voltammetry는 전류와 전위의 관계를 i-E curve를 통해 확인 해보는 분석법입니다.
그렇다면 이런 forward scan과 backward scan이 반복된다면, 저희는 어떤 i-E curve를 얻을 수 있는지 알아보겠습니다.
2. CV for non-faradiac system
LSV를 공부할 때, non-Faradaic system에서의 i-E curve를 확인해봤습니다.
CV에서도 매우 비슷한 결과를 확인할 수 있는데요.
아래 그림 3을 보겠습니다.
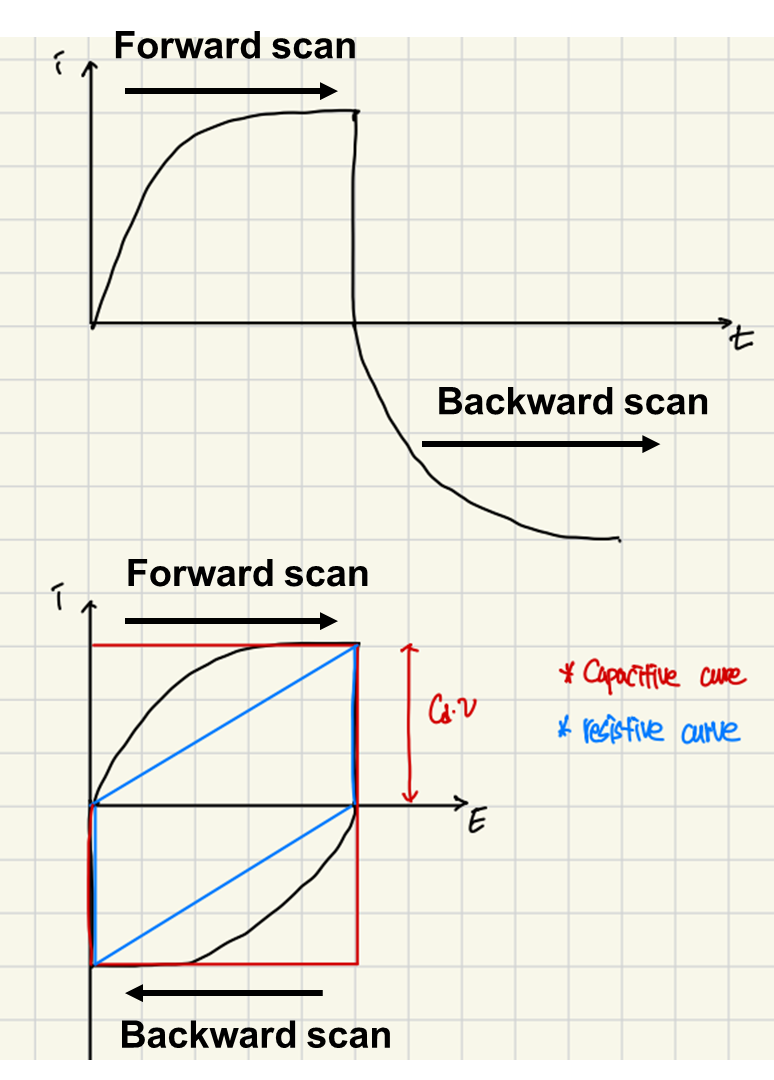
그림 3의 위 그래프인 i-t (current vs. time) curve를 확인해보면 forward scan에서 뒤집인 모양의 backward scan을 확인할 수 있습니다.
그래프의 x축인 시간을 E (potential)로 바꿔주면 그림 2의 input stimulus에서 볼 수 있듯이, 다시 initial potential로 돌아오기 때문에, 그림 3의 아래 그래프와 같은 i-E curve을 확인할 수 있습니다.
역시 최대 전류는 Cdν로 나타낼 수 있고 capacitive하고 resistive의 중간의 그래프를 확인할 수 있습니다.
3. CV for faradaic system
Faradaic system에서 CV 분석을 통해 시스템의 산화/환원 반응을 확인할 수 있고, 전류값을 통해 농도를 정량화할 수 있는 방법입니다.
아래 그림 4에서 일반적인 CV 결과인 i-E curve를 확인해보겠습니다.

논문의 figure에 제가 몇몇 부분(화살표, 단어 등)을 추가했는데요..
그림 4에서 cathodic scan이 진행되면서 A → B → C → D 로 환원 반응이 일어나는 것을 확인할 수 있습니다.
이어서 anodic scan이 진행되면서 D → E → F → A 로 산화 반응이 일어납니다.
(Fc+ 는 ferrocenium, Fc는 ferrocene, E1/2 = half-wave potential, (Epc + Epa)/2)
전류는 아래 식으로 나타낼 수 있고, 아래 식을 통해 전극 표면에서의 concentration gradient가 전류에 큰 영향을 주는 것을 확인할 수 있습니다.

그럼, 각 지점에서 전류의 concentration gradient를 확인해보겠습니다.
먼저, 환원 반응의 경우를 그림 5를 통해 알아보겠습니다.

y축이 농도를 나타내고, x축이 표면~bulk 거리를 나타내는 그래프입니다.
초기에 산화종만 존재하는 시스템이기 때문에 A에서 y축이 1인 파란선이 산화종의 농도이고, 0인 초록선이 환원종의 농도임을 확인할 수 있습니다.
Foward scan에서 negative potential이 가해지면서 B에서 보듯이 산화종이 전극 표면에서 환원됩니다. Bulk의 산화종이 농도차로 인해 전극 표면으로 mass transfer로 이동합니다.
결과적으로, 전극 표면의 산화종 농도가 감소하고, 환원종의 농도가 증가합니다.
(알아보기 쉽게 그래프에 따로 빨간 선으로 concentration gradient와 투명한 파란 막대로 diffusion length를 표시했습니다.)
C에서, concentration gradient가 최대가 되고, 따라서 peak current를 가지게 됩니다. 이 때의 전위가 Ep,c 입니다.
이어서 D에서 산화종의 농도는 0이지만, 증가된 diffusion length로 인해 concentratino gradient는 C보다 작게 됩니다.
이제, 산화 반응을 살펴보겠습니다 (그림 6).

다시 anodic scan으로 환원종이 산화되고, 산화종의 농도(파란선)이 증가하기 시작합니다.
F 에서 산화종의 concentration gradient가 가장 크고 여기서 역시 peak current를 가지게 되고 이 때의 전위가 Ep,a라고 합니다.
환원 반응과의 차이점은 diffusion length가 변하지는 않는다는 것을 확인할 수 있고, G에서 완전히 활성종의 농도가 1과 0으로 나눠지지 않는다는 것으로 알 수 있습니다.
이번 시간에는 CV의 기본적인 원리와 각 시스템에서 i-E curve가 어떻게 나오는지를 간단하게 알아봤습니다.
CV는 시스템이 가역적인지? 어떤 반응이 일어나는지?에 대하여 중요한 정보를 주고,
여러 scan rate에서 찍어봄으로서 시스템의 특성을 파악할 수 있는 유용한 분석법입니다.
다음 포스팅에서는 reversible system의 CV가 어떻게 표현되는지와 CV의 scan rate dependency한 특징을 알아보겠습니다.
Reference)
https://doi.org/10.1021/acs.jchemed.7b00361
※ 아직 많이 부족한 학생의 개인 공부용 포스팅입니다.
※ 잘못된 정보에 대해서 너그럽게 말씀해 주시면 감사하겠습니다.

※ 저작권의 문제가 있을 시 수정 및 삭제하겠습니다.
'Electrochemistry > Cyclic Voltammetry (CV)' 카테고리의 다른 글
| CV(3), semi-empirical relationship between current (i) and potential (E) (0) | 2025.02.26 |
|---|---|
| CV (2), reversibility in CV curve? scan rate dependency? 에 관하여 (0) | 2025.02.03 |