안녕하세요. 이번 리뷰할 논문은 "A redox mediated zinc electrode for ultra-robust deep-cycle redox flow batteries. Huang, S. et al., Energy Environ. Sci., 2023, 16, 438" 입니다.
Zinc-based Redox Flow Battery (ZRFB)에서는 zinc electrode에서 zinc dendrite로 성장으로 인해 "dead zinc"가 형성되고, 그에 따라 수명이 단축되는 문제가 있습니다.
이 논문은 dead zinc보다 redox potential이 큰 redox mediator를 활용하여 dead zinc를 자발적으로 산화 시켜 알칼라인 시스템에 용해 시켜 가용 가능한 zinc의 용량을 회복시키는 연구에 관한 논문입니다.
Introduction
Zinc alkaline system에서 zinc는 negative electrolyte에 Zn[(OH)4]2-형태로 저장되어 있고 redox reaction을 통해 Zn가 plating (charge)/stripping (discharge)됩니다.
이러한 반응이 불균일하게 발생하여 전극에서 dendrite zinc가 성장하게 되고 결국 떨어져 나가 dead zinc를 형성하게 됩니다.
Dead zinc는 싸이클 수명에 직접적으로 영향을 주게 됩니다.
따라서 이를 제어하기 위해 많이 연구되고 있는데, 이 논문에서는 redox mediator를 이용합니다.
Concepts
아래의 그림 1이 이 논문에서 주장하는 전체적인 scheme입니다.
Zn[(OH4)]2- 가 충전할 때 산화되어 carbon felt에 deposit됩니다. 싸이클 중 불균일한 plating/stripping으로 인해 zinc dedrite가 성장하고, 그림과 같이 "dead zinc"가 형성되게 됩니다.
"Dead zinc"가 형성되게 되면 아까 말씀드린 거와 같이 가용 가능한 용량을 줄고, 이는 곧 싸이클 수명이 준다는 것을 의미합니다.

이 "dead zinc"를 산화 시켜 다시 alkaline electrolyte에 용해 시키는 것이 목적인데요. (보시듯이 alkaline system입니다!)
이러한 자발적인 반응을 위해 redox-maditor (RM)을 사용하는데, 여기서는 7,8-dihydroxyphenazine-2-sulfonic acid (DHPS)를 사용했습니다.
DHPS는 Zn보다 redox potential이 커 자발적으로 환원되고, Zn는 Zn2+로 산화되어 알칼라인 시스템에 용해됩니다. 환원된 DHPS2-는 다시 전극에서 산화되어 DHPS로 돌아오고, 이러한 반복적인 반응이 가역적으로 반응한다는 것입니다.
DHPS-mediated zinc chemistry

먼저, CV curves (그림 2(a))를 먼저 확인해보겠습니다.
Zn/[Zn(OH)4]2- 와 DHPS/DHPS-2H의 E1/2를 비교한 결과 DHPS/DHPS-2H의 E1/2이 더 postive한 potential을 보입니다.
따라서 자발적으로 DHPS가 Zn를 산화시킬 수 있게 되는데요.
다음으로 그림 1(b) 그림을 통해 반응을 관찰하겠습니다.
그림 1(b)는 in-situ UV-vis 분석 결과입니다. Caption을 첨부하지는 않았지만, DHPS에 과량의 zinc를 넣고 DHPS의 농도를 분석한 결과입니다.
결과를 보면, 시간이 지날수록 470 nm 부근의 peak intensity가 감소하고, 360 nm 부근의 peak intensity가 증가합니다. 각각 DHPS, DHPS-2H를 나타내는 peak입니다.
결과적으로 시간이 지나며, DHPS의 환원 반응을 관찰할 수 있습니다.

그림 3의 FTIR 결과를 통해서도 역시 이를 관찰할 수 있습니다. Zinc를 넣은 후, C=N peak 감소와 C-N peak 증가를 확인할 수 있습니다.

이는 위 그림 4와 같은 반응의 결과입니다.

따라서, 그림 5의 반응식(2)를 통해 DHPS가 Zn를 산화시키는 구나 라는 것과 환원된 형태인 DHPS-2H는 전극에서 다시 산화 되어 반응이 이루어지는 것을 알 수 있습니다.
Kinetics study
열역학적으로 자발적인 반응이 일어나긴 하지만, 이를 RFB에 적용하기 위해선 얼마나 빨리 반응이 일어나는지도 매우 중요한 문제입니다.
이를 알기 위해서 kinetics study을 진행했습니다.
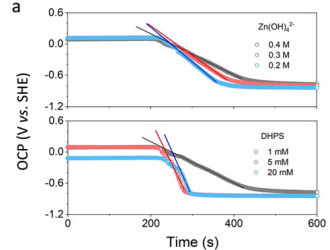
화질이 좀 안좋긴 하지만 그림 6은 [Zn(OH)4]2-와 DHPS의 농도에 따른 OCP 측정입니다. (역시 과량의 zinc를 넣은 후 실험합니다.)
그림 6의 위의 그림을 먼저 보겠습니다.
[Zn(OH)4]2-의 농도가 다양합니다. DHPS의 농도는 고정되어 있습니다. 그럼 이 두 활성종이 반응을 하여 전위가 변합니다 (Nernst equation에 따라서).
이 시스템의 반응을 Nernst equation에 대입하여 풀어보면 그림 7의 식 ①인 b (그림 6의 기울기)로 나타낼 수 있습니다.
또한, 유효전류(ieff)는 그림 7에서 식 ②와 같이 나타낼 수 있습니다.

따라서 유효전류와 기울기(b)의 관계를 아래의 논문의 식 (7)처럼 표현할 수 있습니다.

여기서 볼 것은 식 (7)의 마지막 농도 항은 특정 overpotential에서 특정값을 가지게 되고, 결과적으로 유효전류는 b (그림 6의 기울기)와 비례하는 것을 알 수 있습니다.
[Zn(OH)4]2-의 농도가 작을수록, DHPS의 농도는 5 mM, 20 mM에서 빠른 반응을 일어난다는 것을 알 수 있습니다.
다음 그림을 살펴보도록 하겠습니다.

그림 8은 x축은 overpotential로 applied potential - formal potential 값입니다. y축은 유효전류의 log scale입니다.
Overpotential이 커지면서 전류가 saturate되어 x축과 평행하게 진행되는 것을 알 수 있는데, 이 구간은 diffusion-limited system입니다.
그리고, 초록 박스의 x축과 y축이 linear한 관계를 따르는 부분이 있는데, 이 부분은 charge-transfer-limited system으로 driving force가 아직 작다고 생각할 수 있습니다.
Tafel region이라고도 부르는데 Tafel behavior을 따르기 때문입니다.
아래 그림 9를 보겠습니다.

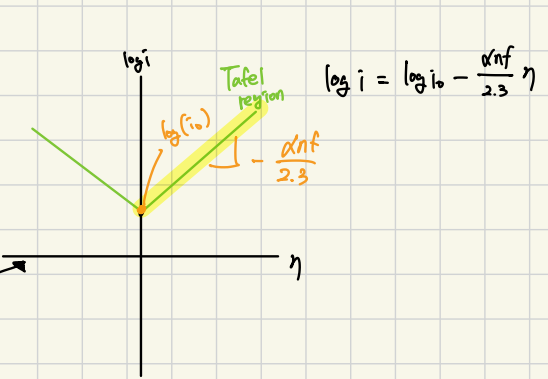
우선, 그림 9의 왼쪽의 전류식은 charge-transfer-limited system에서의 전류식입니다. α (transfer coefficient)를 1로 두고, 환원종인 DHPS-2H가 초기에 존재하지 않기 때문에 cathodic process만 간주합니다.
그럼 식 ①과 같이 전개할 수 있습니다.
또한, 노트에 적지는 않았지만 교환전류(i0)가 나오는데 i0는 equilibrium state (η=0)에서의 전류입니다.
Equilibrium state (η=0)에서는 산화 반응과 환원 반응이 평형을 이루어 전류가 0이죠?
그 때의 절댓값인 전류를 i0라고 합니다.
그럼 i0는
$i_{0} = nFAk^{0}C_{DHPS}^{*}$
로 표현할 수 있고, 여기서 다른 값들은 constant이고, i0는 k0와 비례합니다.
결국 i0를 통해 k0를 비교할 수 있습니다.
그림 9의 오른쪽 그림은 Tafel region에서 i0는 η=0에서의 전류값이니까 y절편을 통해 구할 수 있고,

논문에서 구한 i0값은 2.7 X 10-5 A입니다. 그림 10의 삽입된 DHPS/DHPS-2H의 i0값은 3.3 X 10-5 A와 비교했을 때 큰 차이가 없어 DHPS가 과량의 zinc를 산화시키는 것은 빠르게 반응하여 일어난다는 것을 확인할 수 있습니다.
Flow batteries
앞 부분을 너무 길게 한 거 같아 여기서는 그냥 관련 reference와 비교한 table이 있길래 대체하겠습니다.

이 연구에서는 전기화학적 반응을 이용하여 "dead zinc"를 회복하고 utilization을 끌어올렸습니다.
이 논문은 전기화학적 지식과 실험 장비 셋업에 대한 인사이트를 주는 논문이었던 거 같습니다.
해당 포스팅은 간략히 작성되었습니다. 자세한 내용을 알고 싶으신 분께서는 아래 레퍼런스를 참조해주세요.
References)
Huang, S. et al., Energy Environ. Sci., 2023, 16, 438
https://doi.org/10.1039/D2EE02402K.
※ 아직 많이 부족한 학생의 개인 공부용 포스팅입니다.
※ 잘못된 정보에 대해서 너그럽게 말씀해 주시면 감사하겠습니다.

※ 저작권의 문제가 있을 시 수정 및 삭제하겠습니다.